NMN과 AKG가 비만을 예방한다
[요약]
비만 예방에 도움이 되는 ‘지방전구세포 분화’를 위해서 ‘NAD+ 합성의 상향 조절’이 필요하며, ‘AKG는 적절한 지방 생성을 촉진’하여 식단으로 인한 비만을 예방합니다.
해당 연구는 NMN+AKG가 비만 관련 대사 장애에 대한 잠재적인 치료가 될 수 있음을 시사합니다.
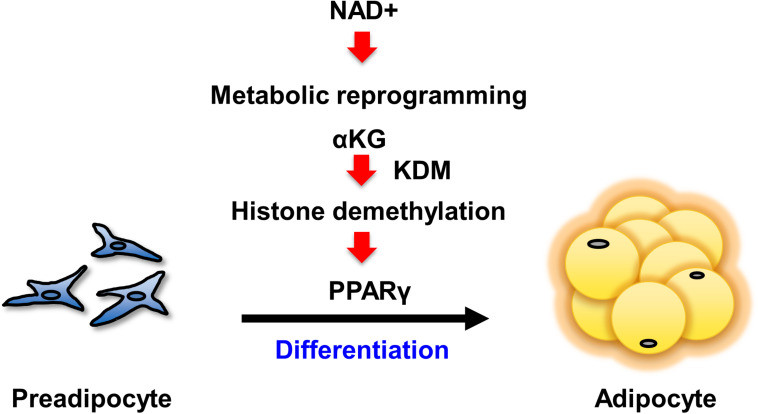
0. 지방전구세포의 분화
일반적으로 비만은 지방전구세포의 분화와 지질합성의 과정에서 발생하는 지방세포의 비대 및 과형성이 원인으로 조직 내 지방세포가 축적됨으로써 유발됩니다.
일본 도야마 대학의 Okabe와 동료들은 Frontiers in Cell and Developmental Biology 저널을 통해 NAD+의 합성 강화가 성숙한 지방의 발달에 중요하다는 기사를 발표한 바 있습니다.
지방전구세포의 분화 과정 중 발생하는 지방세포의 과형성에서 PPAR-γ의 발현은 지방전구세포가 지방세포로 분화할 때 관여하는 것으로 알려져 있습니다. 따라서 생리활성물질을 이용하여 지방세포의 분화조절을 연구하는 것은 비만과 비만 유래 대사질환의 발병을 제어하는 데 매우 중요합니다.
* PPAR-γ: 지방세포에 존재하여, 작용제(agonist)와 결합하면 지질 당 대사에 관여하는 여러가지 유전자를 활성화하고 인슐린 저항성과 지질 당 대사를 개선시키는 작용을 하는 지방분화의 주된 조절자 물질
1. 지방 축적에서 NAD+의 역할은 무엇일까요?
지방생성(지방세포의 성숙)은 정밀하게 제어되는 과정입니다. 지방전구세포(preadipocytes)란 지방세포로 분화되기 이전의 세포를 의미하며, 지방세포가 지방전구세포로부터 유래될 때, 이 과정은 수백 가지 단백질의 발현을 조정하는 전사인자의 정교한 네트워크에 의해 조절됩니다. 전사인자의 조절에 의해 지방전구세포 분화가 중단되면, 지방세포가 부풀어 오르고 염증 및 대사 기능 장애로 이소성 지질 축적이 발생합니다.
2. 지방전구세포 분화를 위해서는 NAD+ 합성의 상향 조절이 필요합니다!
Okabe와 동료들은 지방전구세포 분화 동안 발생하는 대사 변화를 연구했습니다. NAD+ 및 NAD+ 전구체인 NMN의 수준이 지방전구세포의 분화 동안 유의하게 증가한다는 사실이 발견되었으며, NAD+와 NMN을 모두 합성하는 효소 수준의 증가를 동반했습니다. 이러한 데이터는 지방전구세포 분화 동안 NAD+ 합성이 상향조절된다는 것을 시사합니다.
다음으로, 연구자들은 지방전구세포 분화를 위해 NAD+ 수준의 증가가 필요한지 연구했습니다. 사전에 지방전구세포의 분화 과정에서 NMN을 합성하는 효소를 억제하여 NAD+ 생산을 차단하였습니다. 또한, 지방전구세포의 분화 유도 후에도 NMN과 NAD+ 수준의 상승을 억제하자 지방전구세포의 분화가 상당히 감소했습니다. 추가로 NMN은 분화를 유도한 지방전구세포를 보충하여 NAD+ 수준과 지방전구세포 세포의 분화를 완전히 회복시키기도 했습니다.
이는 지방전구세포 분화를 위해서는 NAD+ 수준의 상승이 필요하다는 것을 입증합니다.
3. 지방 세포 성숙을 위한 유전자 프로그램은 NAD+ 합성에 의해 조절됩니다!
Okabe와 동료들은 지방 세포 성숙이 NAD+ 수준에 의해 영향을 받는지 여부를 조사했습니다. NAD+ 수치가 감소하자, 지방 생성의 주요 조절자인 PPARγ와 표적 지방 생성 유전자가 크게 억제되었습니다.
이러한 결과는 PPARγ를 유도하기 위해서는 NAD+가 상향 조절되어야 하며 NAD+ 대사가 지방 생성 동안 PPARγ 유도에 관여한다는 것을 나타냅니다.
4. AKG는 지방전구세포 분화에서 PPARγ 활성화를 조절합니다!
연구진은 PPARγ DNA 서열의 탈메틸화가 억제될 때 PPARγ 활성화 및 지방전구세포 분화 수준이 억제된다는 사실을 발견했습니다. 따라서 PPARγ가 활성화되기 위해서는 PPARγ DNA 서열이 탈메틸화되어야 합니다.
* 탈메틸화(demethylation): 분자에서 메틸기(–CH3)를 제거하는 화학적 과정
또한, 대사산물인 AKG는 효소를 탈메틸화하는 보조 인자로 알려져 있습니다. AKG의 수준은 지방전구세포 분화 동안 유의하게 증가했으며, 이는 NAD+ 수준의 증가와 상관관계가 있습니다. 반면에 NAD+ 수준의 감소는 지방전구세포 분화가 유도된 후 AKG 수준의 상승을 억제했습니다.
연구진은 NAD+, AKG 및 지방 생성 사이에 연관성이 있는지 확인하고 싶었습니다. 이를 위해 그들은 지방전구세포에 AKG를 보충했습니다. AKG는 PPARγ 수준과 지방전구세포의 분화를 유도했으며, 이들 모두는 NAD+ 합성을 억제함으로써 억제되었습니다.
이는 NAD+에 의해 증가된 AKG 수준이 PPARγ 유전자의 탈메틸화에 필요하며, 지방전구세포 분화로 이어진다는 것을 입증합니다.
5. AKG는 적절한 지방 생성을 촉진하여 식단으로 인한 비만을 예방합니다!
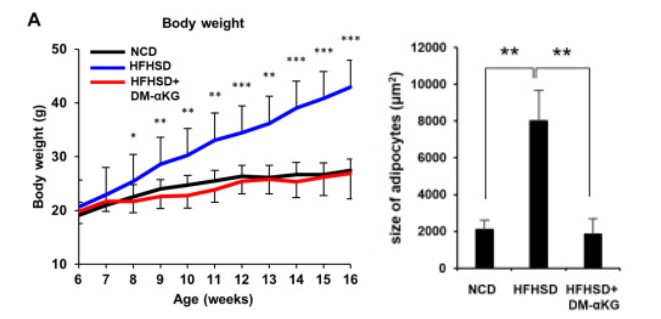
마지막으로 연구진은 NAD+와 AKG가 비만에 어떻게 영향을 미치는지 연구했습니다. 비만을 유발하는 고지방, 고당 식이를 먹인 쥐에게 식수에 AKG를 경구 투여했습니다. 놀랍게도 AKG 투여는 식이 유발 비만을 완전히 억제하여 일반 식이를 먹인 쥐와 유사했습니다.
이어서 연구자들은 이들 쥐의 지방 조직의 물리적 특성을 조사했습니다. AKG 비투여군은 비만 유도 식단으로 인해 지방세포가 부풀어 오른 반면, AKG 투여군에서는 지방세포의 크기가 현저히 작아졌습니다. 또한, 비만 유도 식단을 먹은 쥐에서 지방생성 프로그램의 유전자 수준이 손상되었지만, AKG 투여로 회복된 바 있습니다.
AKG를 보충하면 적절한 지방 생성을 촉진하여 생쥐의 식이 유발 비만을 예방할 수 있습니다.
왼쪽 그래프는 16주에 걸쳐 서로 다른 식단을 먹은 쥐의 체중변화를 보여줍니다. 일반 사료(NCD, 검은색)를 먹인 쥐의 체중은 고지방 고당 식단(HFHSD, 파란색)을 먹은 쥐보다 훨씬 낮았습니다. 고지방 고당 식이를 먹인 일부 생쥐는 식수에 AKG(HFHSD+DM-αKG, 빨간색)를 보충하여 생쥐의 체중 증가를 예방했습니다.
또한, 오른쪽 표에서 연구진은 지방 조직의 지방세포 크기를 조사한 바 있습니다. 고지방 고당 식이요법은 지방세포 크기의 부종을 유발한 반면, AKG 투여군의 지방세포 크기는 고지방 고당 식이요법군에 비해 유의하게 작았습니다.
6. NMN 또는 AKG가 인간의 비만을 예방할 수 있나요?
결론적으로, 해당 연구는 NMN+AKG가 비만 관련 대사 장애에 대한 잠재적인 치료 표적임을 시사합니다. 단, 이러한 효과가 인간에서 재현 가능한지 여부를 조사하려면 추가 연구가 필요합니다.
[참고논문 및 출처]
[1] Study Zeroes In On NAD+ Metabolism and α-Ketoglutarate to Combat Obesity : https://www.nmn.com/news/nmn-novel-therapeutic-approach-combat-obesity
#nmn비만 #nmn지방세포 #akg비만 #akg지방세포 #akg효능 #로킷아메리카